Célula infectada por adenovirus.
ADENOVIRIDAE
Los adenovirus fueron aislados y caracterizados al estudiar el origen de muchas enfermedades del tracto respiratorio superior a mediados del siglo veinte. Los nombres iniciales que con que les bautizaron los investigadores reflejan este tropismo hacia el tracto respiratorio: adenoid degeneration (AD), respiratory illness (RI), adenoidal-pharyngeal-conjunctival (APC) o acute respiratory disease (ARD) agents. El prefijo adeno- proviene del tejido a partir del cual fueron aislados por primera vez, es decir, el tejido glandular adenoide. Los estudios epidemiológicos demostraron que los adenovirus eran causantes de un gran número de síndromes respiratorios febriles agudos. Aunque pronto también quedó claro que los adenovirus eran los causantes del resfriado común y se les responsabiliza del 5-10% de los casos de enfermedad respiratoria infantil, así como de una pequeña fracción de la morbilidad respiratoria en la población general; no son, sin embargo, los causantes de la gripe. Además, los adenovirus también causan conjuntivitis epidérmica y han sido asociados a una variedad adicional de síndromes clínicos, entre los cuales destacan las gastroenteritis infantiles.
En 1962 se descubrió que el tipo 12 inducía la formación de tumores malignos tras su inoculación en hámsters recién nacidos. Esa fue la primera vez que un virus humano mostró capacidad oncogénica. A pesar de su habilidad inductora de tumores in vitro y de transformación de cultivos celulares, no se ha probado que los adenovirus causen cáncer en el ser humano, aunque sí existe un informe que vincula a un RNA relacionado con los adenovirus con tumores neurogénicos. Los intentos por encontrar genoma adenovírico en tumores humanos han fracasado. Esta capacidad tumorgénica ha determinado que los adenovirus sean considerados como importantes modelos para ensayos sobre oncogénesis.
Acualmente ya han sido identificados unos 100 miembros del grupo adenoviral, cuyos huéspedes incluyen mamíferos y aves. Todos contienen un DNA de doble cadena lineal (dsDNA) dentro de una cápside icosaédrica de unos 70 a 100 mm de diámetro y no presentan envuelta.
Sus cualidades han hecho que sean valorados en los laboratorios: facilidad de propagación, inducción de infecciones agudas sincrónicamente en líneas celulares establecidas y genoma fácilmente manipulable. Los estudios de las células infectadas por adenovirus han contribuido al conocimiento sobre la expresión y regulación genética virales, replicación, control del ciclo celular y regulación del crecimiento celular. La contribución más destacable de este grupo de virus fue el descubrimiento del proceso de splicing del mRNA, ya que los estudios del mRNA adenoviral rebelaron la existencia de los intrones.
Actualmente los adenovirus están siendo intensamente explorados como vectores para terapia génica.
Célula infectada por adenovirus.
La siguiente tabla muestra las enfermedades más frecuentes causadas por adenovirus:
| Enfermedad: | Grupos de riesgo: |
| Enfermedad respiratoria aguda | Militares, escolares etc. |
| Faringitis | Niños |
| Gastroenteritis | Niños |
| Conjuntivitis | Toda la población |
| Pneumonia | Niños, militares |
| Queratoconjuntivitis | Toda la población |
| Cisitis hemorrágica aguda | Niños |
| Hepatitis | Niños, trasplantados de hígado |
CLASIFICACIÓN
Los adenovirus constituyen la familia Adenoviridae, dividida en dos géneros:
A pesar de la existencia de reacción antigénica cruzada entre los miembros de cada género debida a la conservación de epítopos localizados en la cápside, no existen antígenos conocidos comunes para todos los adenovirus. Unos 47 serotipos adenovirales han sido clasificados en base a su resitencia a la neutralización con antisuero contra otros serotipos adenovirales conocidos.
Los serotipos se clasifican en 6 subgrupos basándose en su habilidad para aglutinar células sanguíneas. La hemaglutinación es inhibida por antisuero específico contra adenovirus del mismo tipo pero no de otro diferente.
Clasificación para mastadenovirus humanos:
| Subgrupo | Grupos de hemaglutinización | Serotipos | Inducción tumoral en animales | Porcentage de G-C en el DNA |
| A IV | escasa o nula | 12, 18, 31 | elevada | 48-49 |
| B I | completa (eritroci-tos de mono) | 3, 7, 11, 14, 16, 21, 34, 35 | moderada | 50-52 |
| C III | parcial(eritrocitos de rata) | 1, 2, 5, 6 | escasa o nula | 57-59 |
| D II | completa(eritrocitos de rata) | 8, 9, 10, 13, 15, 17, 19, 20, 22-30, 32, 33, 36-39, 42-47 | esacasa o nula (tumores de mamíferos) | |
| E III | 4 | escasa o nula | 57-61 | |
| F III | 40, 41 | desconocida | 57-59 |
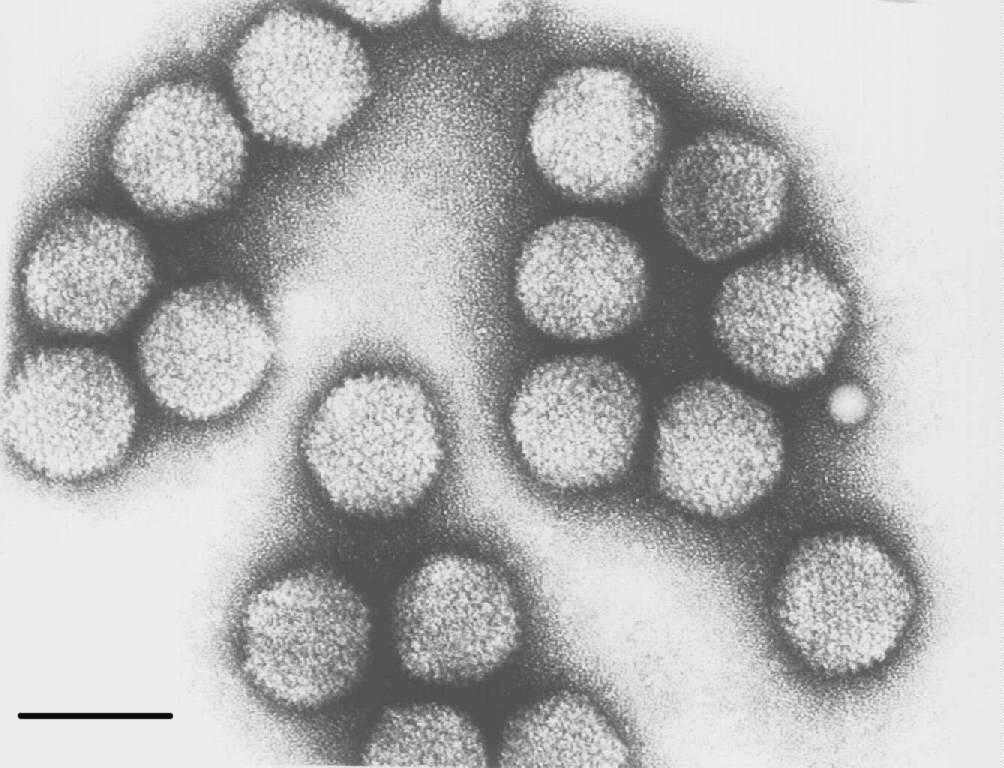
Microfotografías electrónicas de Mastadenovirus
Microfotografía electrónica de Aviadenovirus
ESTRUCTURA
Sus cápsides icosaédricas poseen 20 superficies triangulares y 12 vértices, en un diámetro total de 70 a 100 mm. La composición de cada partícula vírica es la siguiente:
Una cápside se compone de 252 capsómeros, de los cuales 240 son hexámeros y 12 pentámeros (simetría 2-3-5). Cada pentámero contiene una base, que forma parte de la superficie de la cápside, y una fibra proyectada hacia el exterior, cuya longitud varía entre los diferentes serotipos.
Los serotipos más estudiados son los estrechamente emparentados 2 y 5. La cápside contiene 7 proteínas, con diferentes polipéptidos, mientras que el núcleo o core contiene 4 proteínas y el genoma viral, el cual contacta con 3 de ellas (polipéptido V, VII y mu), ricas en arginina. La proteína VII es la mayor y probablemente sirva como un centro histone like alrededor del cual se encuentra el DNA; el polipéptido V conecta el core y la cápside, mientras que la función del polipétido mu es desconocida. La cuarta proteína es la llamada proteína terminal y se une covalentemente (fosfodiester) al extremo 5’ del DNA. Esta proteína sirve de primer para la replicación del genoma vírico y media la unión entre éste y la matriz nuclear.
La secuencia del DNA de Ad2 (Adenovirus tipo 2) rebela 35,937 pb, mientras que la de Ad5 contiene un 95% de DNA idéntico al de Ad2, exceptuando en la región codificadora de la fibra.
El DNA adenovírico contiene secuencias repetidas e inversas en sus extremos, de unas 100 a 140 pb, dependiendo del serotipo. Estas secuencias posibilitan el proceso de recircularización de la cadena de DNA, algo imprescindible para su replicación.
La determinación estructural de la cápside se ha logrado gracias a la combinación de la cristalografía de rayos X y al microscopio electrónico. La estructura de la mayor proteína de la cápside (el hexámero) se ha determinado con una resolución de 2.9 angstroms mediante rayos X. Ésta se forma por la unión de dos trímeros mediante una estructura ß, resultando en dos dominios: un techo triangular hacia el exterior y una base hexagonal con una cavidad central. Una proteína de menor densidad, el polipéptido IX, estabiliza la cápside al situarse entre las interfases de los hexámeros, en un lugar específico.
La estructura tridimensional completa de una partícula vírica ha sido determinada a una resolución de 35 angstroms mediante reconstrucción de la imagen a partir de microfotografías electrónicas.
La proteína fibrilar que surge de cada vértice está compuesta por 3 copias del polipéptido IV. Sus residuos amino-terminales se hayan unidos a la base del pentámero. El número de unidades repetidas difiere entre los diferentes serotipos. El extremo carboxil-terminal contribuye a la formación de un bulbo terminal.
El core contiene una población heterogénea de fragmentos de DNA, cuya longitud se haya comprendida entre las 50 y las 300 pb y que se hayan asociados al polipéptido VII. Aunque la razón de tal variabilidad en longitud no se conoce, está claro que la cromatina se organiza en partículas de DNA y polipéptido. El core se organiza en 8-10 dominios, conteniendo al menos 4 proteínas:
La siguiente tabla resume las proteínas de la cápside de adenovirus:
| Nombre | Localización: | Funciones conocidas: |
| II | Monómero hexamérico | Estructural |
| III | Base pentamérica | Penetración |
| IIIa | Asociada con la base pentamérica | Penetración |
| IV | Fibra | Unión al receptor,hemaglutina. |
| V | Core: asociado con el DNA y la base pentomérica | Histone-like; empaquetamiento? |
| VI | Polipéptido menor hexomérico | Estabilización,ensamblado de la parttícula? |
| VII | Core | Histone-like |
| VIII | Polipéptido menor hexomérico | Estabilización,ensamblado de la parttícula? |
| IX | Polipéptido menor hexomérico | Estabilización,ensamblado de la parttícula? |
| TP | Genoma – proteína terminal | Replicación del genoma |
Esquema de la estructura de un adenovirus
Siguiente